بیشترین گاز موجود در هوا چیست.در این مطلب خوزستان خبر به بررسی بیشترین گاز موجود در هوا می پردازد که از شما می خواهیم تا انتهای این مطلب با ما همراه باشید.
هوا مخلوطی از مقادیر مختلفی از گازها است. بیشترین گاز موجود در هوا این مخلوط از 78٪ نیتروژن و 21٪ اکسیژن تشکیل شده و آرگون و دیگر گازها نیز حدود 1٪ هوا را تشکیل می دهند.
دی اکسید کربن یکی از ترکیبات مهم جو است که مقدار آن از 0.1٪ تا 0.3٪ متغیر است. تغییر مقدار دی اکسید کربن عمدتاً به فرایندهای فتوسنتز و احتراق مربوط است.گازهای دیگر به عنوان مثال دی اکسید سولفور، دی اکسید نیتروژن، ازن و غیره در مقادیر بسیار کم در جو یافت می شوند. بخار آب نیز یک جزء مهم هوا است که میزان آن از منطقه ای به منطقه دیگر متفاوت است.
اگر به ترکیبات شیمیایی جو و نیز وجود حیات بر روی زمین توجه کنیم در می یابیم که نیتروژن، اکسیژن و دی اکسید کربن به همراه بخار آب اجزای تشکیل دهنده جو هستند که با فرایندهای حیات ارتباط دارند.
گاز نیتروژن از نظر شیمیایی به صورت غیر ترکیبی و غیرفعال است. در موجودات زنده، نیتروژن به شکل اسیدهای آمینه و پروتئین ها حضور دارد. در خاک، نیتروژن به صورت نیترات، نیتریت و ترکیبات آمونیوم یافت می شود.
با جذب نیترات و نمک های آمونیوم از سوی موجودات زنده، نیتروژن غیرآلی وارد سیستم های زنده می شود. پس از این که نیتروژن در داخل سیستم های زنده جایگیر می شود طی مراحلی بازیابی می شود. این چرخه نیتروژن نامیده می شود.
با وقوع رعد و برق، نیتروژن جو با اکسیژن واکنش نشان می دهد و اکسید نیتروژن تولید می شود که به وسیله باران یا برف و به شکل نیتروژن و یا اسید نیتریک به زمین حمل می شود.
برخلاف نیتروژن، اکسیژن ماده ای بسیار واکنش پذیر است. واکنش پذیری اکسیژن برای حیات بیشتر گیاهان و جانوران ضروری است. در واقع سوخت و ساز بدن را می توان به عنوان یک فرایند اکسیداسیون کارآمد در نظر گرفت. در تنفس، حیوانات و گیاهان اکسیژن را دریافت می کنند و دی اکسید کربن و بخار آب را بیرون می دهند.
اکسیژن جو از فعالیت فتوسنتزی گیاهان به وجود می آید. گیاهان دی اکسید کربن را در مجاورت نور خورشید می گیرند و اکسیژن آزاد می کنند.
هر چند در مقایسه با نیتروژن و اکسیژن، مقادیر بسیار کمتری دی اکسید کربن در جو وجود دارد، اما برای بقای زندگی موجودات حیاتی است. زنجیره غذایی با فتوسنتز شروع می شود، که طی آن گیاهان در مجاورت نور خورشید از دی اکسید کربن و آب استفاده می کنند تا قند و نشاسته بسازند. سطح دی اکسید کربن جو همچنین در تعیین دمای جهان نقش بازی می کند.
هوا حاوی بخار آب نیز هست. آب موجود در هوا وابسته به دما است و بنابراین بسیار متغیر است. با این حال حدود نیمی از رطوبت هوا در طول یک تا یک و نیم کیلومتری از سطح زمین باقی می ماند و به ندرت فراتر از 10 کیلومتری بالای سطح زمین یافت می شود.
علاوه بر گازها و بخار آب، هوا حاوی ذرات جامد ریز نیز هست. این ذرات زمانی که قابل مشاهده هستند به نام گردوغبار شناخته می شوند و منشأ زمینی دارند. این گردوغبار عمدتاً در داخل محدوده 1.8 کیلومتری بالای سطح زمین یافت می شود.
جو به صورت یک عایق حرارتی عمل می کند و به توزیع گرما در طول روز و تغییرات دما در شب کمک می کند. همچنین ارتعاشات صدا و انتقال آنها به دلیل وجود جو ممکن است.
از همه مهم تر این که بدون جو، هیچ آب و هوا یا بارانی، هیچ پوشش گیاهی ای و هیچ پدیده آب و هوایی ای وجود نخواهد داشت. بدون این پوشش، زمین در معرض بسیاری از اشعه های مرگبار ناشی از خورشید باقی می ماند، این وضعیت برای هر نوع حیاتی بر روی زمین نامطلوب است.
نسبت درصد گازها تقریباً در سراسر جو، دست کم تا ارتفاع 24 کیلومتری از سطح زمین ثابت باقی می ماند. اما این در مورد هوای اطراف شهرستان های بزرگ و مراکز صنعتی صادق نیست، جایی که در آن در نتیجه احتراق سوخت در نیروگاه ها و اتومبیل ها و همچنین تراکم انسان ها دی اکسید کربن افزایش و اکسیژن کاهش می یابد.
اکسیژن :
هوای اطراف ما ترکیبی از گازها، بیشتر نیتروژن و اکسیژن است، اما مقدار کمی بخار آب، آرگون، دیاکسیدکرین و مقدار بسیار کمی از گازهای دیگر نیز دارد. هوا همچنین شامل ذرات معلق، هاگها و باکتریها نیز میشود. به خاطر عملکرد باد، ترکیب فعلی هوا در ارتفاعات و مکانهای مختلف تنها مقدار کمی فرق دارد. جدول زیر بیانگر ترکیب نمونه رایجی از هواست که در آن تمام بخار آب و ذرات معلق را حذف کردند.
مقدار آب موجود در هوا هم تا حد فوق العادهای به موقعیت، دما و زمان بستگی دارد. 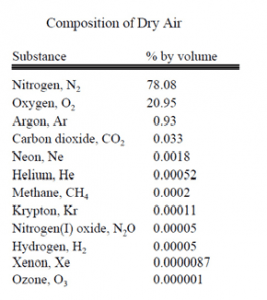 در دشتها و در دماهای پایین، مقدار بخار آب میتواند کمتر از 1% حجم هوا باشد. در مناطق گرم و مرطوب، هوا شاید بیش از 6% بخار آب داشته باشد.
در دشتها و در دماهای پایین، مقدار بخار آب میتواند کمتر از 1% حجم هوا باشد. در مناطق گرم و مرطوب، هوا شاید بیش از 6% بخار آب داشته باشد.
هوا منبع تجاری برای بسیار ی از گازهای موجود در آن است. اجزای آن با استفاده از تقطیر جزء به جزء هوای مایع جدا میشوند. پیش از آنکه هوا به مایع تبدیل شود، بخار آب و کربن دیاکسید حذف میشوند، زیرا این مواد در زمان سرد شدن به جامد تبدیل شده و لولههای کارخانه هوای مایع را مسدود میکند. هوای خشک و فاقد دیاکسیدکربن تا حدود 200 اتمسفر فشرده میشوند. این فشردهسازی منجر به گرمی هوا شده و این هوا با عبور هوای فشرده از رادیوتورها حذف میشود. هوای سرد و فشرده امکان توسعه سریع را مییابد. این توسعه سریع منجر به سردی هوا شده و بنابراین سردی مقداری از هوا را متراکم میسازد. فشردهسازی و توسعه هوا به صورت تناوبی منجر به مایعشدن مقدار زیادی از هوا میشود.
نیتروژن از هوای مایع با استفاده از تقطیر در دمای 196- درجه سانتیگراد بدست میآید. گاز حاصل از این فرآیند در اصل ترکیبی از نیتروژن و حدود 1٫25% گازهای نجیب، آرگون، نئون، کریپتون و زنوناست. نیتروژن بعد از اسید سولفوریک دومین ماده از نظر حجم تولیدی در صنایع شیمیایی آمریکا است. کاربرد اصلی آن به عنوان پوشش اتمسفری خنثی در فرآیند شیمیایی(14%)، الکترونیک (15%) و فرم مایع آن به عنوان عامل انجماد (21%) استفاده میشود. نیتروژن هم برای کودهای کشاورزی استفاده میشود مانند آمونیاک و نیترات. این امر همچنین در تولید اکریلو نیتریلCH2=CHCN، استفاده میشود، این ماده در تولید الیاف مصنوعی مانند اولون و تولید سیانامید، HN=C=NH مهم است، که در پلاستیک ملانین پلیمریزه میشود. از آنجا که نیتروژن عامل اکسید کننده خیلی ضعیفی است، برای بستهبندی مواد قابل اکسایش مانند قهوه استفاده میشود، این اتمسفر خنثی در تولید مولفههای الکترونیکی استفاده میشود. نیتروژن مایع از آنجایی که بسیار سرد است، به طور گسترده برای محافظت مواد غذایی در یخ خشک، و در فرآیند تولید استفاده شده است که به دمای پایین نیاز دارد، مانند ماشین آلات آلومینیومی.
گاز سبک و نجیب نئون از هوا بدست آمده است. نقطه جوش نئون(246- درجه سانتیگراد) بسیار پایین است، تا در طول فرآیند مایعسازی هوا منقبض شود، و نئون در گاز کنسانتره میشود و همچنان بعد از هوای مایع باقی میماند (گاز باقیمانده بیشتر از مقدار موجود در هواست) گازهای نجیبسنگین تر آرگون، کریپتون و زنونبا استفاده از تقطیر هوای مایع بدست میآیند. این بخش با استفاده از شرایط درست، تقریباً 60% گاز نجیب، 30% اکسیژن و 10% نیتروژن از هوای مایع بدست میآیدو اکسیژن با عبور از مس گرم جدا میشود، اکسیژن با مس گرم واکنش نشان داده و اکسید(دو) مس، CuO را ایجاد میکند. گاز باقیمانده ترکیبی از گازهای نجیب و نیتروژن است. این ترکیب گازی است که برای پرسازی لامپ های رشته ای استفاده میشود. نیتروژن از ترکیب با عبور از روی منیزیم داغ حذف میشود، منیزیم با نیتروژن واکنش نشان داده و نیترید منیزیم Mg3N2 را ایجاد میکند. گاز باقی مانده ترکیبی از آرگون، نئون، کریپتون و زنون است. از آنجایی که این عناصر از نظر شیمیایی واکنش ناپذیر هستند، از واکنش شیمیایی نمیتوان برای جداسازی آنها استفاده کرد. آنها با استفاده از جذب ترکیب مایع در زغال فعال در دمای بسیار پایین جدا میشوند. وقتی این زغال فعال به آرامی گرم میشود، هر گاز به صورت منفرد در طیف دمایی خاصی جذب میشود. وقتی دما تا 80- درجه سانتیگراد بالا میآید، گاز رها شده تقریباً آرگون خالص است. وقتی دما بالاتر میرود، تقریباً کریپتون و زنون خالص آزاد میشوند.
آرگون فراوانترین و پرکاربردترین گاز نجیب است. کاربرد اصلی آن در متالوژی است، این گاز فضایی خنثی را فراهم میکند تا در آن بتوان با فلزات داغ کار کرد. از آنجا که آرگون به شدت واکنشناپذیر است، مانع از این میشود که واکنش شیمیایی با فلزات داغ ایجاد شود یا جوش بخورد. شاید آشناترین کاربرد گازهای بیاثر همان نشانههای نئون باشد. این لامپها با استفاده از لولههای شیشهای روشن و بیرنگ ساخته میشوند و معمولاً گازی درون آنهاست که نور را در زمان عبور جریان الکترونیکی ساطع میکند. نئون خالص در لوله نور نارنجی-قرمزی را تولید میکند و آرگون نور آبی-سبز تولید میکند (گازهای دیکر هم استفاده میشوند، به عنوان مثال بخار جیوه نور آبی تولید میکند. دیگر رنگها هم با استفاده از شیشههای رنگی، ترکیب گازها، فلورسنت موجود در داخل لوله ایجاد میشوند.).
تقریباً تمام اکسیژن تجاری (بالای 25%) با استفاده از تقطیر جزء به جزء هوای مایع تولید میشود. اکسیژن در183- درجه سانتیگراد به جوش میآید. اکسیژن از نظر مقدار حجم تولیدی در آمریکا رتبه سوم را دارد و اغلب محصولات تولیدی آن بیش از 99٫5% خالص هستند. اکسیژن پارامغناطیس است، که جذب آهنربا میشود. اکسیژن مایع به رنگ آبی روشن است. استفاده اصلی تجاری از اکسیژن مربوط به تولید فلزات (30%)، ساخت فلزات (33%)، خدمات سلامتی (13%) میشود. در صنعت فولاد، اکسیژن از روی آهن مذاب ناخالص در کوره ذوب آهن عبور داده میشود تا آن را اکسیده سازد و ناخالصیهایی مانند کربن، گوگرد، فسفر و سیلیکون را حذف کند. اکسیژن همچنین به عنوان اکسیدان در مشعل برش فولاد استفاده میشود. در این فرآیند، فولاد با استفاده از شعله اکسیژن استیلن گرم میشود و جریانی از اکسیژن داغ به سمت این فولاد داغ هدایت میشوند. فولاد داغ با استفاده از اکسیژن داغ اکسیده شده و نابود و منجر به برش فولاد میشود. اکسیژن همچنین به صورت گسترده در صنایع شیمیایی مانند تولید اسید نیتریک HNO3 از آمونیاک NH3 استفاده میشود.
واکنش اکسیژن با گازی دیگر منجر به انفجار میشود. دو دلیل برای این انفجار وجود دارد، بنابراین دو نوع انفجار داریم. انفجارهای گرمایی که به خاطر اثرات دما بر سرعت واکنش رخ میدهد. انفجارهای زنجیره واکنش که ناشی از رفتار ملکولهای واکنش است.
در انفجار گرمایی، گرمای آزاد شده از واکنش دمای مخلوط واکنش را افزایش میدهد. این افزایش در دما منجر به افزایش در میزان واکنش میشود. اگر دمای آزاد شده از واکنش نتواند فرار کند، وقتی فشار بالا برود، ترکیب در این شرایط به صورتی میشود که هر ملکول گرم نمیتواند چندان حرکت داشته باشد و انرژی در آن حبس میشود. بنابراین، احتمالاً در فشارهای بالا این انفجار حرارتی رخ دهد.
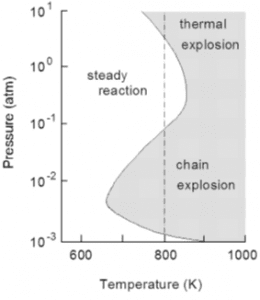 در انفجارهای زنجیره واکنش، واکنش به صورتی اتفاق میافتد که تعدادی از اجزای که قدرت واکنشپذیری بالایی دارند (که به آنها رادیکالهای آزاد میگوییم) در طول واکنش افزایش مییابد. واکنش هیدروژن و اکسیژن به این صورت رخ میدهد. اگر فشار بسیار کم باشد، احتمال دارد که رادیکالهای آزاد به دیوارهای محفظه پیش از واکنش با دیگر ملکولها برخورد کنند و هیچ انفجاری رخ ندهد. اگر فشار بالا باشد، احتمالاً رادیکالهای آزاد با یکدیگر برخورد کرده و زنجیره واکنش را پایان میدهند و انفجاری رخ نمیدهد. تنها وقتی رادیکالهای آزاد با ملکولها برخورد کنند و تعدادی رادیکال آزاد دیگر را تولید کنند و زنجیره واکنش ادامه یابد، انفجار رخ میدهد. بنابراین، انفجارهای زنجیره واکنش احتمالاً در فشارهای متوسط رخ میدهند.
در انفجارهای زنجیره واکنش، واکنش به صورتی اتفاق میافتد که تعدادی از اجزای که قدرت واکنشپذیری بالایی دارند (که به آنها رادیکالهای آزاد میگوییم) در طول واکنش افزایش مییابد. واکنش هیدروژن و اکسیژن به این صورت رخ میدهد. اگر فشار بسیار کم باشد، احتمال دارد که رادیکالهای آزاد به دیوارهای محفظه پیش از واکنش با دیگر ملکولها برخورد کنند و هیچ انفجاری رخ ندهد. اگر فشار بالا باشد، احتمالاً رادیکالهای آزاد با یکدیگر برخورد کرده و زنجیره واکنش را پایان میدهند و انفجاری رخ نمیدهد. تنها وقتی رادیکالهای آزاد با ملکولها برخورد کنند و تعدادی رادیکال آزاد دیگر را تولید کنند و زنجیره واکنش ادامه یابد، انفجار رخ میدهد. بنابراین، انفجارهای زنجیره واکنش احتمالاً در فشارهای متوسط رخ میدهند.



